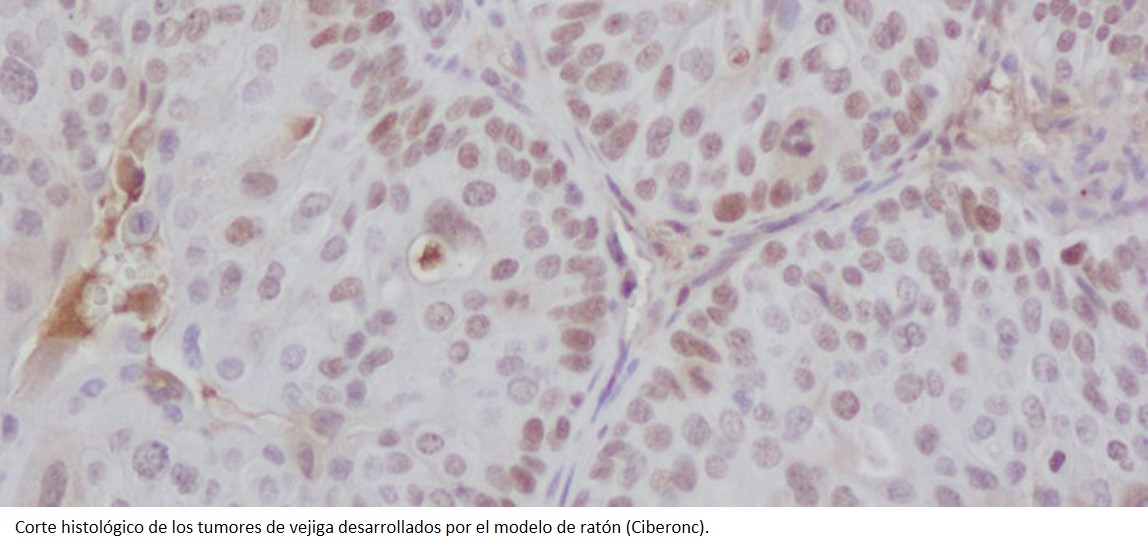
La combinación de un anticuerpo monoclonal, inmunomodulador e inhibidor del proteosoma podría ser el tratamiento estándar del mieloma múltiple (MM) en recaída tras lenalidomida.
El estudio, denominado MMY 001, es uno de los muchos que se llevan a cabo en la HUNET del Hospital 12 de Octubre. Con seis años de recorrido y el respaldo de la Fundación Cris contra el Cáncer, la HUNET ha sido pionera en España como unidad centrada en exclusiva en las enfermedades hematológicas.
Fuente: Diario Médico