La apuesta del ‘i+12’ por el relevo generacional se convierte en una de sus máximas prioridades.
El Instituto de Investigación del Hospital 12 de Octubre, i+12, apuesta por el relevo generacional con un programa propio y específico, el ‘Transforma 12‘, para captar talento joven entre los clínicos investigadores. Gracias a esta iniciativa, este centro público de la Comunidad de Madrid ha incorporado seis profesionales que se suman a otros tres contratos Juan Rodés, el máximo número de ayudas que concede en este tipo de convocatoria el Instituto de Salud Carlos III.
El doctor Joaquín Arenas, director del Instituto de Investigación i+12 explica el motivo por el cual este relevo generacional se ha convertido en una de sus máximas prioridades. “El objetivo es movilizar este tipo de perfil, de joven investigador y clínico, que combine la asistencia y la investigación. Una doble actividad que cada vez se hace más difícil de incorporar, pero que hay que incentivar porque nuestros investigadores principales ya tienen una edad media muy elevada. Vamos a seguir necesitando profesionales que encabecen ensayos y proyectos de investigación y que los trasladen a la clínica”.
A esta acción específica, se suma la ayuda obtenida a través del programa Fortalece del Instituto de Salud Carlos III (ISCIII). El i+12 es uno de los tres institutos de investigación de Madrid que ha conseguido esta financiación dirigida a reforzar las líneas estratégicas más importantes. En el caso del i+12 su propuesta estaba formada por cuatro grupos de investigación consolidados (Oncología Torácica y Clínico Traslacional, Investigación Cardiovascular, Hematología Traslacional y Enfermedades Neurovasculares) y dos emergentes (Microambiente Tumoral e Inmunoterapia y Ejercicio Físico y Cáncer Pediátrico).
Estos programas de refuerzo buscan igualmente consolidar el camino de la excelencia científica del Instituto de Investigación i+12 que, en 2023 se mantiene en cuanto al número y la calidad de los proyectos abiertos y los ensayos clínicos, así como en el número de publicaciones científicas indexadas que, en este caso, se supera con respecto a 2022. Todo ello hace del i+12, uno de los centros de investigación punteros a nivel nacional, con especial referencia al área del cáncer.
ENSAYOS CLÍNICOS, PROYECTOS DE INVESTIGACIÓN Y PUBLICACIONES
Son 240 ensayos clínicos y 79 ensayos observacionales los concedidos al Instituto de Investigación del Hospital 12 de Octubre. En total 319, de los cuales el 55 por ciento (176) corresponden al Área del Cáncer, especialmente los dirigidos a los grupos de investigación de Oncología Torácica, Hematología, Cáncer de mama, Biomarcadores en Tumores Genitourinarios y Tumores Gastrointestinales y Neuroendocrinos. Seguida del Cáncer, está el Área Cardiovascular, enfermedades Crónicas y Trasplante, Enfermedades Inflamatorias y Trastornos Inmunitarios, Enfermedades Infecciosas y SIDA y el Área de Neurociencias y Salud Mental. El número total de ensayos e investigaciones clínicas activos o que han permanecido abiertos en 2023 ha sido 1.179.
Con respecto a los proyectos concedidos, son 68 nuevos proyectos de investigación, 28 (41 por ciento) provenientes del ISCIII. Del mismo modo, del total de 372 proyectos activos o que seguían abiertos en 2023, 135 están subvencionados por el ISCIII (36 por ciento). Una cifra que habla de la importancia del i+12 en la captación de proyectos públicos de Investigación en Salud.
El i+12 ha obtenido en 2023 una financiación de casi 46 millones de euros (45.954.420), más de 23 millones (23.487.715) de financiación pública en convocatorias competitivas, de los cuales 16 millones provienen del ISCIII, además de otros 22 millones (22.466.705) de financiación no competitiva a través de ensayos clínicos, estudios observacionales, donaciones, convenios o acciones de docencia. Por otro lado, ha conseguido cerca de dos millones (1.755.885) de financiación privada, especialmente de la Asociación Española contra el Cáncer (AECC) y la Fundación Cris.
En cuanto a las publicaciones indexadas por los investigadores del i+12 en 2023, alcanzan un total de 1.174 (artículos originales, revisiones y editoriales) que representan un factor de impacto global de 12.063,20 puntos y un Factor de Impacto Medio de 10,275. Esto significa el incremento un año más del impacto generado por la producción científica del Instituto, 407,75 puntos superior a la producción científica generada en el año 2022.
El 62,68 por ciento se han publicado en revistas de primer cuartil (Q1) y, de éstas, el 43,40 por ciento corresponden a revistas de primer decil (D1) (27,03 por ciento del total).
INNOVACIÓN Y FORMACIÓN
Cabe destacar también la actividad desarrollada por la Unidad de Apoyo a la Innovación del i+12, a lo largo de 2023, con una potente y creciente cartera de proyectos de innovación, incluyendo dos spin-off, TNC terapia y STAb Therapeutics y siete solicitudes de patentes (suman un total de 62 en vigor) y tres de marcas españolas o la firma de 15 acuerdos con terceros (alianzas, convenios marco y específicos) y la participación en diferentes convocatorias de innovación.
Por otra parte, los resultados de los trabajos de investigación llevados a cabo por los profesionales del Instituto i+12 han dado lugar a su participación en la publicación de 30 Guías de Práctica Clínica, Documentos de Consenso y Recomendaciones. Además, han participado en un total de 37 tesis doctorales, cuatro de ellas con mención internacional.
El Instituto de Investigación i+12 es una estructura funcional de investigación biomédica multidisciplinar y traslacional orientada a la investigación básica, clínica, epidemiológica y en servicios de salud. Más de 900 investigadores forman parte de este centro de investigación del Hospital 12 de Octubre.



 ción en las UCI enfrentan desafíos significativos debido a la fragmentación de datos, la falta de acuerdos estandarizados para compartir información y una infraestructura segura insuficiente. Estas barreras se hicieron evidentes durante las primeras etapas de la pandemia de COVID-19, cuando preguntas básicas como “¿Cuántos pacientes que necesitan soporte ventilatorio están ingresados en las UCI?” resultaron difíciles de responder.
ción en las UCI enfrentan desafíos significativos debido a la fragmentación de datos, la falta de acuerdos estandarizados para compartir información y una infraestructura segura insuficiente. Estas barreras se hicieron evidentes durante las primeras etapas de la pandemia de COVID-19, cuando preguntas básicas como “¿Cuántos pacientes que necesitan soporte ventilatorio están ingresados en las UCI?” resultaron difíciles de responder.



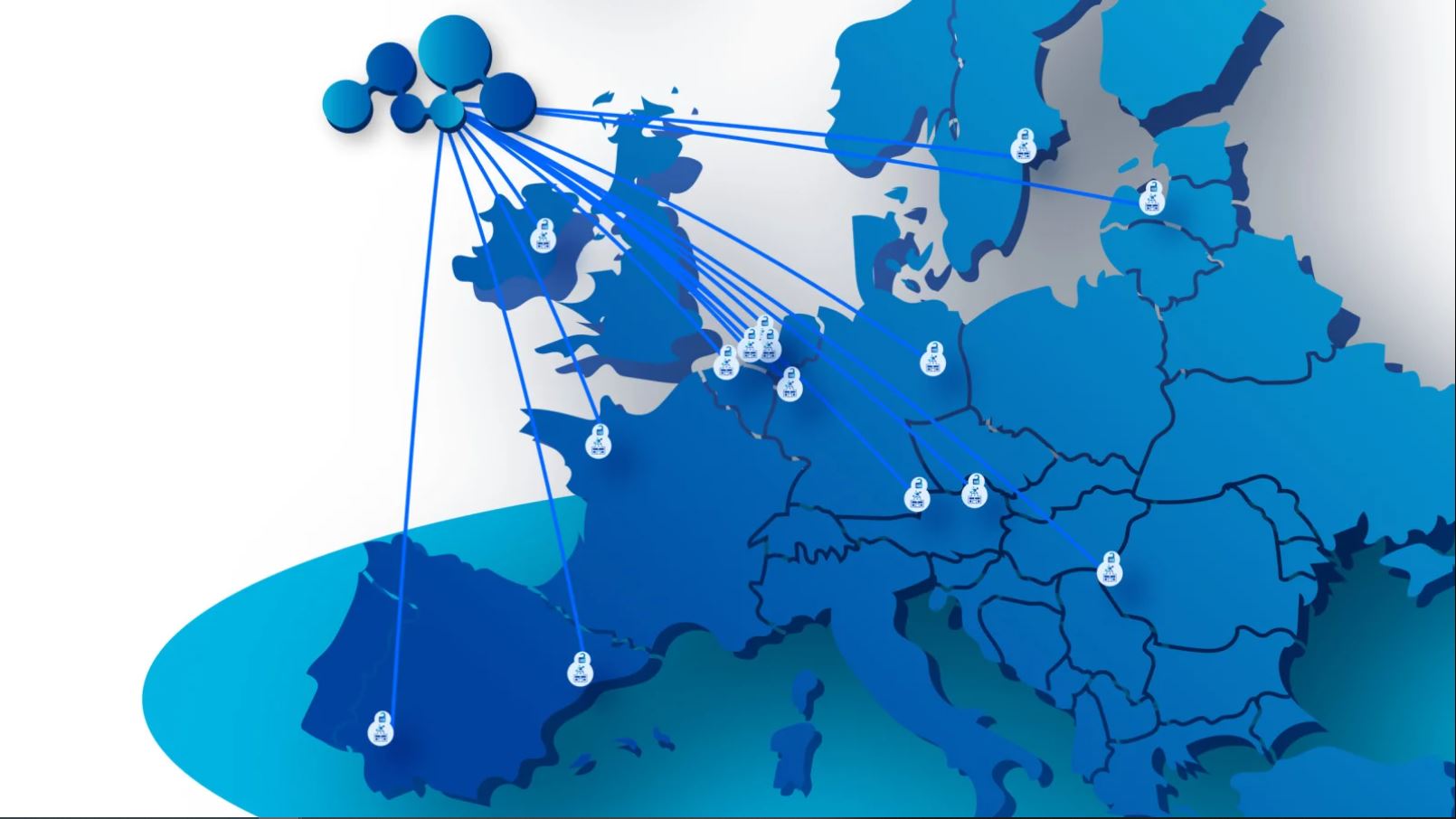
 El objetivo de este grupo es diseñar e implementar proyectos piloto que permitan conocer los datos existentes sobre las ECV y la diabetes, estandarizar y armonizar los métodos de recopilación de datos, así como mejorar los mecanismos de intercambio de los mismos para crear una red dedicada a registros de estas patologías en Europa. Algunos de los proyectos que se están desarrollando desde el CNIC y el Instituto de Investigación Sanitaria Hospital 12 de Octubre (i+12) – SERMAS abordan cuestiones relevantes como las diferencias de género en la salud cardiovascular o la ayuda al autocuidado en pacientes con ECV.
El objetivo de este grupo es diseñar e implementar proyectos piloto que permitan conocer los datos existentes sobre las ECV y la diabetes, estandarizar y armonizar los métodos de recopilación de datos, así como mejorar los mecanismos de intercambio de los mismos para crear una red dedicada a registros de estas patologías en Europa. Algunos de los proyectos que se están desarrollando desde el CNIC y el Instituto de Investigación Sanitaria Hospital 12 de Octubre (i+12) – SERMAS abordan cuestiones relevantes como las diferencias de género en la salud cardiovascular o la ayuda al autocuidado en pacientes con ECV.