Investigadores de la Universidad Autónoma de Madrid (UAM) pertenecientes al grupo de investigación Metabolismo Energético Traslacional del Instituto i+12, han demostrado en un estudio publicado el 03 junio de 2020 en la revista The EMBO Journal, que el desarrollo de enfermedades metabólicas sistémicas es dependiente de la actividad muscular de la enzima mitocondrial ATP sintasa, cuello de botella de la producción de energía biológica.
En este trabajo, utilizando un modelo de ratón que expresa de manera regulada el inhibidor de la actividad de la ATP sintasa específicamente en el músculo esquelético, se ha demostrado que los ratones que tienen parcialmente inhibida la actividad de sus mitocondrias acumulan grasa y son más propensos a desarrollar diabetes de tipo 2 cuando se alimentan con una dieta grasa. La crisis energética mitocondrial modifica el metabolismo de la célula muscular que pasa a consumir aminoácidos ramificados como fuente de acetil-CoA para la síntesis de lípidos. Esto genera una alteración en las especies lipídicas y en la producción de radicales del oxígeno, que finalmente contribuyen a la aparición de la resistencia a la insulina. Mediante un cribado de fármacos, ya aprobados por la FDA para su uso en clínica, los investigadores han identificado el antioxidante edaravone como un potente activador de la función mitocondrial y, por lo tanto, como un posible tratamiento para este tipo de enfermedades metabólicas.

El trabajo ha sido dirigido por Laura Formentini, investigadora Ramón y Cajal de la Universidad Autónoma de Madrid (UAM), quien dirige un grupo emergente integrado en el laboratorio del Profesor J.M. Cuezva en el Centro de Biología Molecular Severo Ochoa (CBMSO, UAM-CSIC).
Además de la UAM y el CSIC, los investigadores están vinculados al Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER-ISCIII) y al Instituto de Investigación Hospital 12 de Octubre (i+12-UAM) y ha participado el Instituto Madrileño de Estudios Avanzados (IMDEA).
Obesidad, diabetes tipo 2 (T2D) y su relación con las mitocondrias.
La obesidad es una condición metabólica crónica que afecta a todos los órganos y sistemas de nuestro organismo hasta el desarrollo de la resistencia a la insulina. En los últimos años se ha puesto de manifiesto el papel central que las disfunciones del músculo esquelético, que es el órgano insulino-sensible más grande de nuestro organismo, juegan en el desarrollo de patologías metabólicas. El músculo es un órgano endocrino que secreta moléculas y responde a hormonas, lo que puede contribuir a la inflamación crónica asociada a estas enfermedades. Además, el músculo es el tejido más dependiente de la actividad de las mitocondrias. Estos orgánulos son esenciales para la homeostasia del músculo, orquestando una r
espuesta celular compleja que controla la producción de energía biológica, la termogénesis, la inmunidad y el metabolismo de aminoácidos y ácidos grasos, así como rutas
de señalización mediadas por calcio y especies reactivas del oxígeno. Por esta razón, no es sorprendente que se hayan puesto de manifiesto alteraciones mitocondriales en biopsias musculares de pacientes que padecen obesidad y/o diabetes. Sin embargo, y en este contexto, era un tema de debate si las disfunciones de la actividad mitocondrial son la causa o una consecuencia de la resistencia a insulina.
“Nuestro trabajo demuestra, por primera vez, que la alteración metabólica que ocurre en las mitocondrias del músculo esquelético es la causa del fenotipo obeso de nuestros ratones, participando este fenotipo en el desarrollo de la diabetes”, afirma Cristina Sánchez González, primera autora del estudio.
Estos hallazgos tienen una gran importancia en el estudio de las enfermedades metabólicas y su posible tratamiento. “En este sentido, la detección precoz de una alteración mitocondrial a nivel muscular podría ser un marcador temprano de la enfermedad, pudiendo ser ésta tratada con edaravone cuando todavía es reversible”, concluyen los autores.
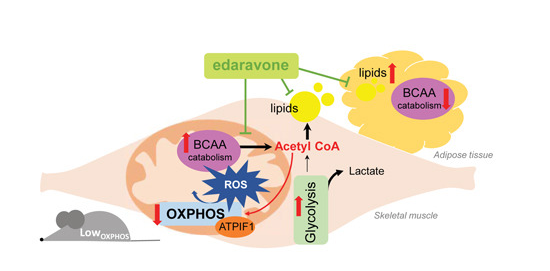
Esquema molecular de como la inhibición de la actividad mitocondrial genera un aumento de la lipogénesis y del catabolismo de los aminoácidos ramificados, contribuyendo a un aumento del peso de los ratones y al desarrollo de enfermedades metabólicas. El tratamiento in vivo con el antioxidante mitocondrial edaravone es capaz de revertir este fenotipo.
Referencia Bibliográfica: Cristina Sánchez‐González, Cristina Nuevo‐Tapioles, Juan Cruz Herrero Martín, Marta P Pereira, Sandra Serrano Sanz, Ana Ramírez de Molina, José M Cuezva, Laura Formentini. Dysfunctional oxidative phosphorylation shunts branched‐chain amino acid catabolism onto lipogenesis in skeletal muscle. The EMBO Journal e103812|2020. DOI: 10.15252/embj.2019103812