Científicos de la Universidad Autónoma de Madrid (UAM) han demostrado que el bloqueo coordinado de la actividad mitocondrial y de la angiogénesis por el nebivolol frena el crecimiento de los tumores de mama y colon.
El cáncer constituye un problema de salud a nivel mundial por los elevados costes sociales y económicos que comporta. Por esto, se hace necesario el desarrollo de nuevas aproximaciones terapéuticas. El reposicionamiento de fármacos utilizados en otras enfermedades para el tratamiento del cáncer es una estrategia alternativa a la búsqueda de nuevas drogas. Esta aproximación minimiza la inversión multimillonaria, así como el tiempo para que las drogas puedan aplicarse al paciente oncológico, ya que sus efectos secundarios son conocidos. Esta estrategia puede ser especialmente relevante en la terapia combinada de pacientes con enfermedad metastásica.
En un estudio publicado en la revista Nature Communications, investigadores del Centro de Biología Molecular Severo Ochoa (CBMSO, UAM-CSIC), también vinculados con el CIBER de Enfermedades Raras (CIBERER-ISCIII) y con el Instituto de Investigación Hospital 12 de Octubre (i+12-UAM), siguiendo la estrategia del reposicionamiento de fármacos, descubren el gran potencial antitumoral del nebivolol, un fármaco anti-hipertensivo, que evita el crecimiento y la angiogénesis de los tumores.
Las mitocondrias, conocidos como la central energética celular, además de producir energía, regulan el metabolismo, la señalización y la toma de decisiones sobre la vida o muerte de la célula. No es de extrañar que la disfunción mitocondrial esté involucrada en la génesis y/o progresión de un gran número de enfermedades, incluyendo el cáncer, la neurodegeneración, el síndrome metabólico, enfermedades raras y el propio envejecimiento. Encontrar las bases moleculares de la disfunción mitocondrial en estas enfermedades y sus potenciales terapias constituye parte de la línea de investigación que dirige el Prof. José M. Cuezva en el CBMSO. Para ello, -explica la Dra. Cristina Nuevo Tapioles, primera autora de este trabajo- hemos buscado fármacos activadores e inhibidores de la respiración mitocondrial, en una librería de más de mil drogas ya aprobados por su uso en pacientes con distintos tipos de enfermedades.
En el trabajo publicado en Nature Communications se han encontrado trece compuestos, pautados para el tratamiento de cinco enfermedades además del cáncer, que cumplen un criterio muy restrictivo como inhibidores de la respiración mitocondrial, que es una diana emergente en el tratamiento del cáncer. Entre ellos, se ha elegido al inhibidor β1-adrenérgico nebivolol, que se emplea como anti-hipertensivo en enfermedad cardiovascular, como candidato para el estudio en detalle de su mecanismo de acción antitumoral porque la capacidad de producción de energía de las mitocondrias depende, en algunas situaciones de la vía adrenérgica.
Los investigadores han descubierto que las células de muy distintos tipos de tumores (mama, colon, pulmón, etc..) expresan receptores β1-adrenérgicos cuya actividad es necesaria para el correcto funcionamiento de sus mitocondrias. Así, el nebivolol, por bloquear estos receptores, inhibe la respiración mitocondrial de las células tumorales sin causar efecto sobre células no tumorales. La acción del nebivolol sobre la mitocondria de la célula tumoral se ejerce a dos niveles y tiene como consecuencia el déficit energético y daño oxidativo por forzar la sobreproducción de especies reactivas de oxígeno (ROS). Por un lado, el nebivolol previene la fosforilación de la subunidad NDUFS7 del Complejo I de la cadena de transporte electrónico (Fig. 1), lo que inhibe su actividad y la respiración. Por otro lado, aumenta la cantidad mitocondrial del inhibidor fisiológico de la ATP sintasa, que es el motor molecular que sintetiza el ATP (moneda energética celular), lo que conduce a la inhibición de su actividad y la caída del ATP celular (Fig. 1). Ambos mecanismos contribuyen a la sobreproducción de ROS (Fig. 1).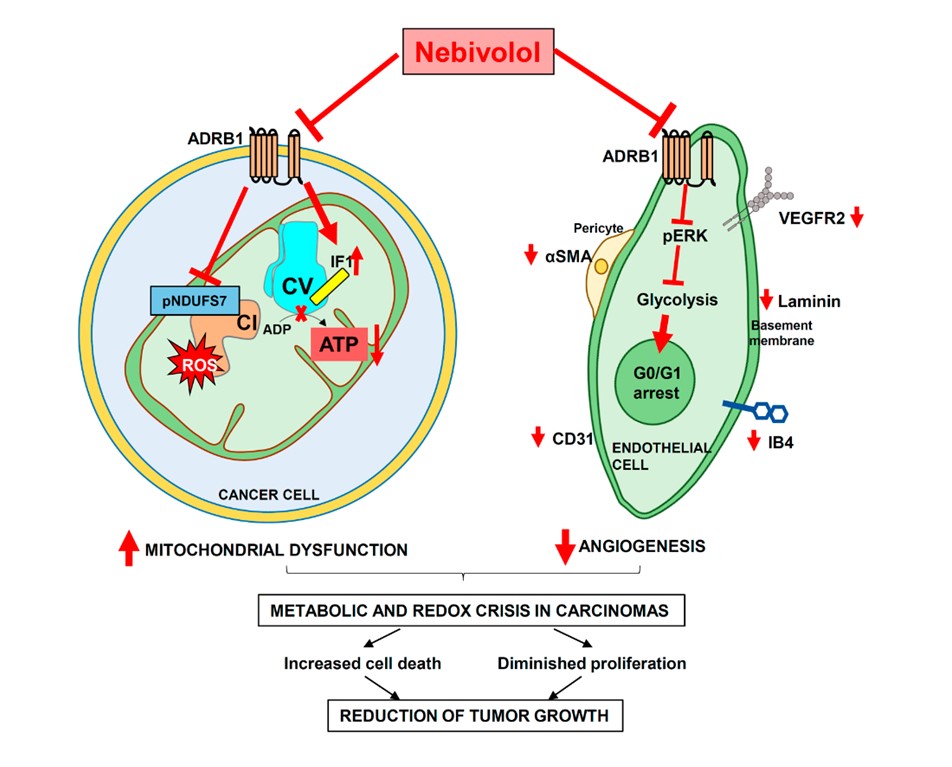 Fig. 1. El tratamiento con nebivolol frena el crecimiento tumoral por inhibir la función bioenergética de la mitocondria y la proliferación de las células endoteliales. Por un lado, actúa sobre los receptores β1-adrenérgicos de las células tumorales inhibiendo el metabolismo mitocondrial a nivel del complejo I y de la ATP sintasa. Por otro lado, actúa sobre los mismos receptores en las células endoteliales inhibiendo su flujo glucolítico y deteniendo así su progresión en la fase G0/G1 del ciclo celular, impidiendo su proliferación. En conjunto, ambos eventos causan una crisis metabólica y oxidativa de la célula frenando el crecimiento tumoral.
Fig. 1. El tratamiento con nebivolol frena el crecimiento tumoral por inhibir la función bioenergética de la mitocondria y la proliferación de las células endoteliales. Por un lado, actúa sobre los receptores β1-adrenérgicos de las células tumorales inhibiendo el metabolismo mitocondrial a nivel del complejo I y de la ATP sintasa. Por otro lado, actúa sobre los mismos receptores en las células endoteliales inhibiendo su flujo glucolítico y deteniendo así su progresión en la fase G0/G1 del ciclo celular, impidiendo su proliferación. En conjunto, ambos eventos causan una crisis metabólica y oxidativa de la célula frenando el crecimiento tumoral.
Además de las dos dianas mitocondriales, los investigadores han descubierto que el tratamiento con nebivolol también inhibe la proliferación de las células endoteliales que son necesarias para generar los vasos sanguíneos que alimentan a los tumores para su crecimiento (Fig. 1). El mecanismo de acción del nebivolol sobre las células endoteliales está mediado por la inhibición de la señalización β1-adrenérgica sobre el flujo glucolítico, que es la vía principal de producción de energía de estas células (Fig. 1). En su conjunto, el nebivolol actúa inhibiendo dos características fenotípicas necesarias para el desarrollo de los tumores, su metabolismo energético y la angiogénesis, lo que produce una crisis metabólica y de estrés oxidativo en las células provocando su muerte e impidiendo el crecimiento del tumor.
En resumen, los investigadores de la UAM han descubierto un nuevo fármaco para el tratamiento del cáncer que ya está aprobado para su uso en humanos, abriendo un futuro esperanzador para los pacientes con cáncer. Por otro lado, sientan las bases para el desarrollo de ensayos clínicos denominados “basket trials” de pacientes oncológicos que tengan como denominador común receptores β1-adrenérgicos en sus células tumorales.
Referencia bibliográfica: Nuevo-Tapioles C, Santacatterina F, Stamatakis, K, Nuñez de Arenas, C, Gómez de Cedrón, M, Formentini, L and Cuezva JM. Coordinate β-adrenergic inhibition of mitochondrial activity and angiogenesis arrest tumor growth. Nat Commun 11, 3606 (2020). https://doi.org/10.1038/s41467-020-17384-1